目前研究和应用最广泛的免疫检查点抑制剂包括CTLA-4、PD-1 以及其配体PD-L1 的抑制剂。免疫检查点抑制剂治疗通过抑制免疫检查点活性,释放肿瘤微环境中的免疫刹车,重新激活T细胞对肿瘤的免疫应答效应,从而达到抗肿瘤的效果。如今,这种免疫检查点疗法彻底改变了临床治疗转移性黑色素瘤患者的方式,而且自2011年首次被批准以来,它们给那些预后非常差(平均生存期低于一年)的和具有很少治疗方法的患者带来了新的希望。
但是应该清醒的认识到,目前,实际上只有约20%~40%的患者能够从这一昂贵的治疗方法中获益,大多数患者要么没有作出反应,要么在治疗后会复发。
近年来,科学家们在免疫检查点抑制治疗方面不断取得进展,让我们一起看看这个领域取得的最新进展。
1.Nat Med:粪便菌群移植可有效治疗免疫检查点抑制剂相关结肠炎
doi:10.1038/s41591-018-0238-9
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员以两名患者为研究对象,首次发现移植来自健康供者的肠道细菌可用来成功地治疗因接受免疫检查点抑制剂(immune checkpoint inhibitor, ICI)治疗引起的严重结肠炎的患者。这表明粪便菌群移植(fecal microbiota transplantation, FMT)值得在临床试验中作为一种常见的免疫疗法副作用的疗法进行研究。相关研究结果于2018年11月12日在线发表在Nature Medicine期刊上,论文标题为“Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis”。论文通讯作者为德克萨斯大学MD安德森癌症中心药物诱导性结肠炎与肠炎主任以及胃肠病学、肝病学与营养学助理教授Yinghong Wang博士。
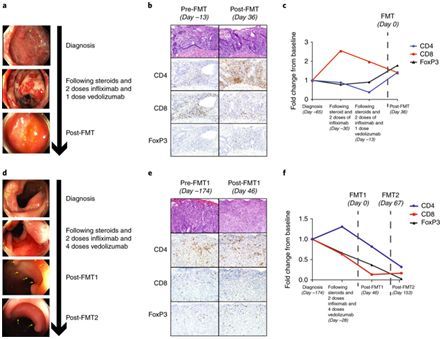 图片来自Nature Medicine, doi:10.1038/s41591-018-0238-9。
图片来自Nature Medicine, doi:10.1038/s41591-018-0238-9。
Wang说,“在接受FMT治疗后,这两名患者的结肠炎消退能够在临床上和在内窥镜检查中得到证实。基于这些结果,这应当作为ICI相关结肠炎的一线治疗进行评估,这是因为在一次治疗后,它安全、快速和效果持久。”
2.Nat Med:肥胖竟可促进PD-1免疫检查点抑制剂治疗癌症
doi:10.1038/s41591-018-0221-5
在一项开创性的新研究中,来自美国加州大学戴维斯分校的研究人员揭示了为什么肥胖会促进癌症生长,并同时又允许新的重磅炸弹免疫治疗药物更好地对抗相同的癌症。这些充满矛盾的发现为癌症医生在给癌症患者选择药物和其他治疗方法时提供了重要的新信息。相关研究结果于2018年11月12日在线发表在Nature Medicine期刊上,论文标题为“Paradoxical effects of obesity on T cell function during tumor progression and PD-1 checkpoint blockade”。论文通讯作者为加州大学戴维斯分校皮肤科副主任William Murphy。
Murphy说,“这是违反直觉的,这是因为到目前为止,我们所有的研究都已显示肥胖导致更多的与免疫治疗相关的毒性。这会引发观念变革,这是因为当我们开展个人化治疗和研究身体质量指数(BMI)时,它在某些情况下可能是不好的,在某些情况下可能是有益的。”
这项新的研究以动物模型和人类患者为研究对象,分析了一类不同的称为免疫检查点抑制剂的免疫治疗药物的疗效。这类药物的作用机制就是阻断癌症用来逃避免疫系统检测的免疫检查点通路。它们包括像派姆单抗(pembrolizumab,商品名为Keytruda)这样的药物,能够极大地提高许多肺癌和黑色素瘤患者的生存率。在这项新的研究中,免疫检查点抑制剂具有与其他免疫疗法不同的效果,而且事实上,相比于非肥胖癌症患者,它们导致肥胖癌症患者具有更高的生存率。
3.Cancer Res:联合靶向miR-146a和PD-1可增强抗肿瘤免疫有效治疗黑色素瘤
doi:10.1158/0008-5472.CAN-18-1397
microRNA是细胞内表达的一些小的非编码RNA,能够在转录后水平调节基因表达,并在多种癌症类型中调控免疫应答反应。最近来自德国弗莱堡大学医学中心的研究人员在黑色素瘤微环境中发现了一种microRNA能够抑制抗肿瘤免疫应答,同时提出了治疗黑色素瘤的新策略。相关研究结果发表在国际学术期刊Cancer Research上。
在这项研究中,研究人员发现miR-146a能够作为免疫激活的负调控因子发挥类似免疫检查点分子的作用。研究表明miR-146a在黑色素瘤微环境组织中存在表达水平增加,miR-146a敲除小鼠存活更久并且相比野生型黑色素瘤荷瘤小鼠形成的转移灶更少。
研究人员从敲除小鼠体内分离了T细胞发现miR-146a的靶基因Stat1和Stat1调控的细胞因子IFN-γ表达水平更高。中和敲除小鼠体内的IFN-γ能够降低小鼠的存活率并增强黑色素瘤的转移。体外实验表明,IFN-γ能够抑制黑色素瘤细胞的迁移、细胞周期活性和基础代谢率。相反,IFN-γ也会增加黑色素瘤细胞内PD-L1水平,这可能会抵消掉一部分有益影响促进体内免疫逃逸的发生。更进一步的研究发现利用miR-146a拮抗剂和抗PD-1抗体进行联合治疗会导致小鼠生存率增加,并且效果好于单独使用抗PD-1抗体。
4.Cell:重大进展!一种免疫抵抗性程序让肿瘤对免疫检查点疗法产生抵抗性
doi:10.1016/j.cell.2018.09.006
在一项新的研究中,来自美国达纳-法伯癌症研究所和布罗德研究所的研究人员通过对黑色素瘤样品进行单细胞RNA测序(scRNAseq),鉴定出恶性肿瘤细胞中存在的一种免疫抵抗性程序,多种免疫抵抗性机制在这种免疫抵抗性程序中受到共同调节,而且这种免疫抵抗性程序可预测黑色素瘤患者对免疫治疗作出的反应,此外,CDK4/6抑制剂可抑制这种免疫抵抗性程序,从而可能让黑色素瘤对免疫治疗变得敏感。相关研究结果发表在2018年11月1日的Cell期刊上,论文标题为“A Cancer Cell Program Promotes T Cell Exclusion and Resistance to Checkpoint Blockade”。
免疫检查点抑制剂在一些黑色素瘤患者中产生持久的反应,但是许多患者并没有获得临床益处,而且产生这种抵抗性的分子基础仍然是未知的。在这项新的研究中,这些研究人员通过对33种黑色素瘤样品进行单细胞RNA测序和开展计算分析来寻找促进免疫逃避的恶性肿瘤细胞状态。
这些研究人员鉴定出恶性肿瘤细胞表达的一种免疫抵抗性程序与T细胞排斥和免疫逃避相关。这种免疫抵抗性程序在免疫检查点抑制剂治疗之前就已表达,是原位冷肿瘤微环境(cold niche in situ)的一个特征。在一个独立的112名黑色素瘤患者群体中,这种免疫抵抗性程序可用来预测患者对抗PD-1疗法作出的临床反应。
这些研究人员还发现CDK4/6抑制剂可抑制恶性肿瘤细胞中的这种免疫抵抗性程序,诱导细胞衰老,而且当在体内与免疫检查点抑制剂(比如抗PD-1抗体)联用时,可降低小鼠模型中的肿瘤生长。
5.Cell:令人吃惊!成功的免疫检查点疗法广泛地重塑肿瘤微环境
doi:10.1016/j.cell.2018.09.030
在一项新的研究中,来自美国华盛顿大学医学院的研究人员通过对利用免疫检查点疗法成功治疗的荷瘤小鼠进行高维分析,发现免疫检查点疗法诱导肿瘤内部的骨髓细胞和淋巴细胞发生变化,肿瘤相关的单核细胞/巨噬细胞表现出复杂的细胞因子驱动的表型,此外,不同的细胞因子作用于肿瘤浸润性的单核细胞,从而驱动巨噬细胞极化(macrophage polarization),即成熟的巨噬细胞在各种因素诱导下表现出表型和功能分化。相关研究结果发表在2018年11月1日的Cell期刊上,论文标题为“High-Dimensional Analysis Delineates Myeloid and Lymphoid Compartment Remodeling during Successful Immune-Checkpoint Cancer Therapy”。论文通信作者为华盛顿大学医学院的Robert D. Schreiber和Maxim N. Artyomov。
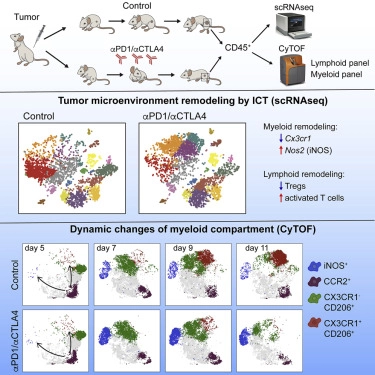 图片来自Cell, doi:10.1016/j.cell.2018.09.030。
图片来自Cell, doi:10.1016/j.cell.2018.09.030。
尽管当前的免疫检查点疗法主要靶向淋巴细胞(比如T细胞),但是它与肿瘤微环境的更广泛重塑有关。在这项新的研究中,这些研究人员确定了来自肿瘤无限制生长的或者接受有效的免疫检查点疗法治疗的同品系小鼠的肿瘤样品中的所有造血细胞的差异。通过利用单细胞RNA测序(scRNAseq)进行无偏见的评估和利用大量细胞计数法(mass cytometry, CyTOF)纵向评估肿瘤浸润性免疫细胞中的蛋白表达,他们揭示出肿瘤内部的淋巴细胞和骨髓细胞发生显著的重塑。
令人吃惊的是,这些研究人员观察到多个单核细胞/巨噬细胞亚群。这些细胞亚群可通过标志物CD206、CX3CR1、CD1d和iNOS加以区分,并且在免疫检查点疗法治疗期间,随着时间的推移,它们以一种部分依赖于干扰素IFNγ的方式发生变化。
6.Cell:新研究使得区分哪些黑色素瘤患者受益于免疫检查点治疗成为可能
doi:10.1016/j.cell.2018.10.038
在一项新的研究中,为了鉴定出肿瘤中的免疫相关因子和确定它们预测免疫检查点抑制反应的能力,美国布罗德研究所细胞回路项目联合主任Nir Hacohen及其团队利用单细胞RNA测序逐个细胞地测量上千种基因的RNA水平以便更清楚地了解接受免疫检查点抑制剂治疗的患者的免疫情况。相关研究结果发表在2018年11月1日的Cell期刊上,论文标题为“Defining T Cell States Associated with Response to Checkpoint Immunotherapy in Melanoma”。
通过分析来自接受免疫检查点疗法治疗的32名患者体内的黑色素瘤的1.6多万个免疫细胞中的RNA水平,这些研究人员鉴定出具有不同基因表达模式的几个细胞亚群,这几个细胞亚群在对治疗有反应或没有反应的肿瘤中更为常见。鉴于CD8 T细胞已知是免疫检查点抑制机制的关键组分,而且在黑色素瘤样本中大量存在,他们着重关注这些细胞。基于基因表达模式,他们最终确定了两种主要的细胞状态:一种细胞状态类似于干细胞样记忆CD8 T细胞的状态,在对治疗作出反应的肿瘤占主导地位,而另一种细胞状态类似于在存在功能障碍的或“耗竭('exhausted)”的T细胞中观察到的情形,在没有反应的肿瘤中更为常见。
通过对来自接受一种PD-1抑制剂治疗的另一组患者的肿瘤进行分析,这些研究人员发现已知在干细胞样记忆CD8 T细胞维持和分化中起着重要作用的转录因子TCF7是作出反应的肿瘤的标志物。论文共同第一作者、美国麻省总医院癌症研究中心的Moshe Sade-Feldman博士说,“重要的是,我们开发了一种简单的染色检测方法:利用CD8 T细胞中的TCF7水平区分作出反应和不作出反应的肿瘤。当前,我们正在与麻省总医院的临床医生和病理学家合作,根据我们的研究开发一组标志物,以便更准确地识别对免疫疗法作出反应的患者。我们还发现肿瘤浸润性的不表达基因CD39和TIM3的CD8 T细胞是TCF7阳性的,并且在细胞研究中,它们在根除对抗PD1疗法作出反应的肿瘤中发挥重要作用。”
通过使用黑色素瘤小鼠模型,这些研究人员测试了阻断这些基因中的一个或两个基因的作用所产生的影响,发现同时阻断CD39和TIM3减少肿瘤大小和增加40天存活。联用CD39抑制剂和被批准上市的PD1或PD1/CTLA4免疫检查点抑制剂会使得在治疗40天后存活下来的小鼠所占的百分比增加三倍。他们还鉴定出了另一种称为BATF的转录因子,它似乎是存在功能障碍/耗竭的CD8 T细胞状态的标志物,而且在不作出反应的肿瘤中高度表达。
7.JCI Insight:突破!仅用一滴血就能监测肺癌患者对疗法的反应
doi:10.1172/jci.insight.59125
近日,一项刊登在国际杂志JCI Insight上的研究报告中,来自日本大阪大学的科学家们通过研究开发出了一种简单的方法来检测纳武单抗对机体的效应,这种方法能够帮助测定患者在接受疗法后数周内纳武单抗与T细胞的PD-1蛋白结合的分子机制,相关研究或能提供关键的信息来帮助研究人员更加有效地治疗癌症患者。
文章中,研究人员对肺癌患者的肺液和血液样本进行分析,测定了与T细胞结合的纳武单抗的水平,同时研究人员还分离了仅与纳武单抗结合的T细胞,从而深入研究细胞的激活作用。研究者发现,纳武单抗对T细胞的效应通常会在患者服药后持续相当长一段时间。Atsushi Kumanogoh博士说道,我们所开发的这种方法在患者中非常可行,即使患者已经停止了治疗,纳武单抗仍然能与患者机体的T细胞结合超过20周时间;此外,纳武单抗停止与T细胞结合时的血浆浓度以及所结合的T细胞百分比在不同患者中都是不一样的。
本文研究结果证实,T细胞的结合水平或许并不能指示药物的功能效应,后期研究人员还需要对T细胞的增殖水平进行测定。研究者Akio Osa说道,对于任何既定的患者而言,我们都需要获取比药物在血液中水平更多的信息,目前我们还需要深入研究测定与T细胞所结合的纳武单抗的水平以及T细胞增殖的程度,从而才能为患者制定更加精准的疗法决策,而本文中我们所开发的方法只需要一滴血就来完成上述分析。
通过对两组参与者进行研究,研究人员阐明了测定T细胞结合程度和增殖速度的重要性,当第一组参与者机体的T细胞增殖水平较低时,其对疗法并没有产生反应,而在第二组参与者中,当其机体T细胞增殖水平升高时,其机体并没有提示肿瘤生长。最后研究者说道,我们所开发的将监测纳武单抗结合及T细胞增殖状态进行组合的策略或许能够帮助更好地确定药物的治疗效果,这种新方法优于当前仅监测纳武单抗在血液中水平的策略。
8.Nat Med:放射治疗可诱导肺癌细胞对CTLA-4阻断产生应答
doi:10.1038/s41591-018-0232-2
放射治疗能够促进抗肿瘤T细胞的激活,这种作用依赖受放射线照射的肿瘤中诱导表达的I型干扰素。而有研究证实在肿瘤小鼠模型中I型干扰素是实现远端抗肿瘤应答的关键因素。接受放射治疗和CTLA-4阻断联合治疗的病人如何实现远端应答,其中的机制还不清楚。最近来自美国威尔康奈尔医学中心的研究人员在国际学术期刊Nature Medicine上报道了他们关于上述问题的最新研究进展。
在这项研究中,研究人员在抵抗化疗并发生转移的非小细胞肺癌病人体内发现放射治疗和CTLA-4阻断能够诱导系统性抗肿瘤T细胞的出现,对于这些病人来说,抗CTLA-4抗体无法单独发挥有效作用,与化疗药物联合使用也没有有效的治疗效果。
研究人员在18%的入组病人体内观察到客观应答反应,31%病人的病情得到了控制。在放射治疗后血清IFN-β出现增加,血液T细胞克隆的早期动态变化是最强力的应答预测事件,也证实了临床前研究的机制研究结果。他们又对一个产生应答的病人进行功能性分析发现CD8 T细胞在体内出现快速扩增,放射治疗诱导一个编码新抗原的基因出现表达上调,而CD8 T细胞可以识别这种新抗原。这项研究也支持了放射治疗可以将抗原突变暴露给免疫系统的假设。