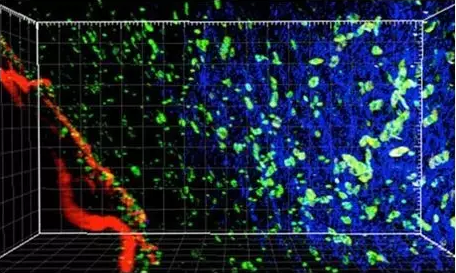
肿瘤的三维显微图显示调节性T细胞(绿色),血管(红色)和肿瘤基质(蓝色)。图片来自Pitt Health Sciences/Vignali Lab。
免疫治疗药物促进免疫系统检测和杀死癌细胞,并且已被成功地用于治疗几种癌症,但是迄今为止,它们仍然仅能有效地治疗10%~30%的患上某些肿瘤类型的病人。这些药物在更多的病人中没有效果的确切原因仍然是个谜。
Treg细胞有助维持我们的免疫系统中的一种微妙平衡。论文通信作者、匹兹堡大学医学院免疫学系副主任Dario Vignali博士说,“它们像调光开关那样发挥作用,让光线变得足够明亮来检测和清除免疫危险,但是当我们自己的细胞遭受损伤时,不会让光线变得如此明亮。”
Vignali说,“在癌症中,Treg细胞能够是有害的,这是因为它们通过调低光线,阻止免疫系统检测和杀死癌细胞。尽管开发出清除Treg细胞的药物可能似乎是一种符合逻辑的治疗方法,但是这可能导致危及生命的自身免疫并发症,从而使得这些药物不适合在癌症患者中使用。因此,我们需要鉴定出选择性地靶向肿瘤中的Treg细胞并且让肿瘤外的那些Treg细胞保持完好无损的方法。”
几年前,Vignali和他的同事们已发现一种被称作神经纤毛蛋白1(neuropilin-1, Nrp1)的表面蛋白是维持Treg细胞在恶劣的肿瘤微环境中的功能、完整性和存活所必需的(Nature, doi:10.1038/nature12428)。Nrp1是在几乎所有浸润到小鼠肿瘤中的Treg细胞表面上表达的。因此,Treg细胞表面上的Nrp1协助抑制身体的天然抗肿瘤免疫反应,因而有助这种肿瘤存活。重要的是,在小鼠体内阻断或剔除Treg细胞中的Nrp1仅影响它们在肿瘤中而不是在体内其余部分中的功能,从而导致肿瘤根除,同时不会诱导自身免疫疾病或炎性疾病产生。
Vignali说,“我们在当前的这项研究中证实在小鼠中,Treg细胞中的Nrp1表达是维持它们阻止免疫系统清除肿瘤能力所必需的。令人关注的是,当Treg细胞缺乏Nrp1时,它们不仅不具有这种抑制能力,而且它们也更加积极地参与抗肿瘤免疫反应。有趣的是,我们也发现在具有较差预后的癌症患者中,表达Nrp1的Treg细胞亚群比例变得更高,这提示着这些发现可能也适用于人。”
为了获得这些发现,这些研究人员培育出一种经过基因改造的模式小鼠:Nrp1基因仅在一半Treg细胞群体中被剔除,但在另一半Treg细胞群体中是完好的。他们发现当与Nrp1在所有Treg细胞中都存在的正常小鼠相比,在这种模式小鼠中的肿瘤生长显著下降。
论文第一作者、Vignali实验室研究生Abigail E. Overacre-Delgoffe说,“缺乏Nrp1的Treg细胞不仅具有下降的调低光线的能力,而且它们也阻止正常的Treg细胞群体执行它们自己的免疫抑制功能。这允许免疫系统检测和攻击肿瘤。”基因组分析和细胞分析结果揭示出在这些小鼠体内,一种分泌的被称作γ-干扰素(IFNγ)的免疫分子阻止Treg细胞的调光开关功能。
利用另一种经过基因改造的模式小鼠,他们发现IFNγ在降低Treg细胞功能中的作用对靶向PD1蛋白的免疫治疗药物的成功性是至关重要的,这些药物已被证实在病人中是非常有效的。Vignali说,“尽管我们认为IFNγ可能影响Treg细胞的功能,因而影响免疫治疗结果,但是这种影响的幅度令我们感到吃惊。当我们剔除Treg细胞中的IFNγ受体时,它们不再对IFNγ的影响变得敏感,这种免疫治疗药物完全没有效果。在本质上,IFNγ似乎让Treg细胞变得如此脆弱以至于它们丢失了它们的抑制功能,但是仅是在肿瘤中发生的。因此,让Treg细胞变得脆弱可能是有效的免疫治疗药物的一种必要条件。”
总的来说,这些研究人员注意到他们的发现是意义重大的,这是因为它们表明如果能够让一部分肿瘤相关Treg细胞丢失它们的免疫抑制功能(可能是通过利用IFNγ实现的),那么它可能足以引起一系列连锁反应,这样的话,这些细胞能够影响其他的肿瘤相关Treg细胞,因而促进抗肿瘤免疫反应产生,同时不会发生不利的自身免疫副作用。此外,在近期而言,追踪Treg细胞的功能脆弱性可能是一种有效的方法来监控免疫治疗药物在病人体内是否是有效的。
参考资料:1.Abigail E. Overacre-Delgoffe, Maria Chikina, Rebekah E. Dadey et al.Interferon-γ Drives Treg Fragility to Promote Anti-tumor Immunity. Cell, 1 June 2017, 169(6):1130–1141, doi:10.1016/j.cell.2017.05.005
2.Targeting Immune Cells that Help Tumors Stay Hidden Could Improve Immunotherapy